La microscopia crioelettronica, una tecnica di imaging che serve a studiare le proprietà delle proteine, potrebbe diventare presto lo standard nella ricerca farmacologica. Lo afferma uno studio pubblicato su Science in cui si riferisce che la qualità delle immagini ottenute è ormai sovrapponibile a quelle catturate con la tradizionale tecnica della cristallografia a raggi X. Il traguardo è stato raggiunto grazie alla messa a punto di sensori ottici e di software che sono stati sviluppati negli ultimi anni. Secondo gli autori della ricerca l’affinamento della tecnica potrebbe consentire di sviluppare molto più facilmente nuovi farmaci. Perché?
Grazie a queste tecniche gli scienziati possono visualizzare nel dettaglio le relazioni spaziali tra le molecole. La cristallografia possiede però il difetto di essere una metodica molto complicata. Per analizzare le proteine, infatti, ha bisogno di produrne milioni di copie che devono essere orientate nella stessa identica direzione per poi essere fissate in un cristallo. Si tratta di una limitazione importante, dal momento non è possibile allineare qualsiasi proteina, specialmente quelle di grandi dimensioni. Il livello di risoluzione è però molto alto, visto che riesce a distinguere dettagli di 0,2 nanometri. In questo modo i ricercatori possono studiare in che modo le molecole si legano alle altre, teorizzando il loro comportamento una volta somministrate a un paziente, nel corso di una terapia. Le potenzialità farmacologiche verranno poi, ovviamente, approfondite nel corso degli studi clinici.
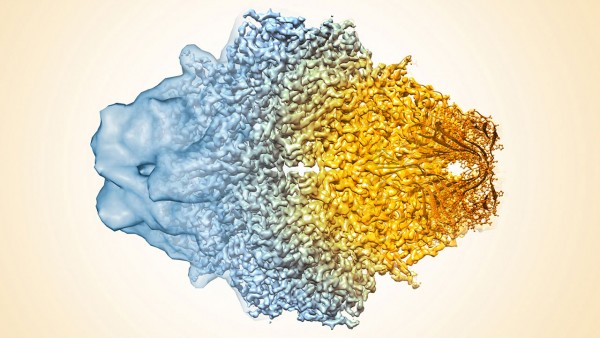
La microscopia crioelettronica utilizza un approccio diverso, che non richiede la creazione di cristalli. La tecnica è un’evoluzione della microscopia elettronica che analizza campioni esposti a potenti refrigeranti, come l’azoto liquido che abbassa la temperatura fino a −195,79 gradi centigradi. Nel dettaglio, molte copie delle proteine vengono raccolte su una sottile pellicola, raffreddata dall’azoto liquido, che viene attraversata da un flusso di elettroni. Questi vengono poi intercettati da un rilevatore che registra il modo in cui sono stati deviati dagli atomi che compongono la proteina. I dati raccolti vengono poi inviati a un computer che si occupa di ricostruire l’allineamento delle proteine e, al loro interno, la posizione degli aminoacidi e, se possibile, degli atomi che le compongono.
Nel caso particolare, la proteina presa in esame è stata quella della beta-galattosidasi. La scelta è stata fatta in funzione del fatto che questa è stata analizzata molto a fondo in passato con altre tecniche e che quindi esistono molte immagini da utilizzare come termine di paragone. I test sono stati soddisfacenti e hanno consentito di “vedere” la proteina con un buon livello di dettaglio, con una risoluzione di 0,22 manometri, abbastanza per far luce sui meccanismi di interazione della molecola. Inoltre la velocità di preparazione dei campioni da analizzare è estremamente più alta, consentendo ai ricercatori di studiare un gran numero di proteine in un tempo molto ridotto. Questo risultato indica la prospettiva di velocizzare di molto l’analisi di potenziali farmaci dei quali possono essere studiate con facilità le caratteristiche morfologiche prima di passare ai test farmacologici veri e propri.
Riferimenti: Science DOI: 10.1126/science.aab1576
Credits immagine: VERONICA FALCONIERI/ SUBRAMANIAM LAB/CCR/ NCI/ NIH