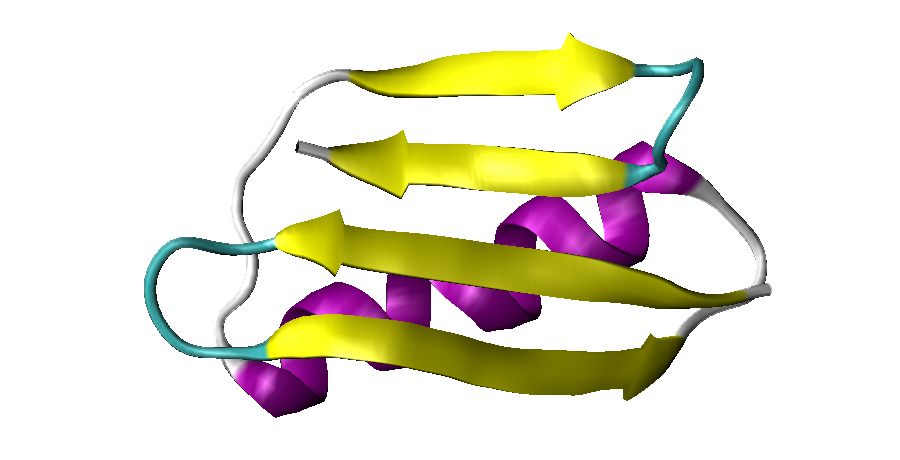
Le proteine oggi si studiano utilizzando complessi programmi computerizzati, che simulano un filamento di aminoacidi mentre si piega su se stesso per assumere una forma specifica. È questa forma tridimensionale, infatti, a conferire alla proteina le sue caratteristiche funzionali. I programmi trattano i filamenti come un insieme di palline, ognuna delle quali equivale ad un atomo, e ne osservano l’evoluzione nel tempo. Come si può immaginare, simulare il processo a livello atomico è un metodo estremamente accurato, ma anche incredibilmente lento, per via delle molte informazioni che devono essere elaborate dal programma. Oggi un gruppo di ricercatori della Sissa di Trieste e dell’Università di Cambridge ha escogitato un trucco che permette di ridurre drasticamente i tempi delle simulazioni. La tecnica è stata presentata su Pnas.
Come funziona il nuovo metodo? “Sfruttiamo i dati sperimentali ottenuti osservando le proteine con la risonanza magnetica nucleare, e con questi creiamo dei vincoli da applicare al modello”, spiega Alessandro Laio, ricercatore della Sissa che ha coordinato lo studio. “In pratica abbiamo usato un trucco. Provate a immaginare che io vi tiri per un braccio verso un certo posto. Con il trucco si impiega un tempo anche 1000 volte inferiore al tempo normale richiesto per quel tragitto. Grazie a regole matematiche posso poi calcolare, partendo dal tempo di percorrenza truccato, quanto quanto avreste impiegato a percorrere quel tragitto senza essere tirati. Ecco, lo stesso tipo di ragionamento si può fare su una proteina che deve ripiegarsi per raggiungere una certa forma”.
La tecnica è stata provata studiando la proteina G del batterio streptococco, e ha permesso di ottenere risultati perfettamente coerenti con quelli della tecnica più comune, ma con tempi di calcolo estremamente ridotti. “Data la lentezza delle normali tecniche di dinamica molecolare al computer, metodi come il nostro ottimizzano i tempi di elaborazione, e potrebbero dare un grosso impulso alla ricerca”, conclude Laio.
Riferimenti: Characterization of the free-energy landscapes of proteins by NMR-guided metadynamics; Daniele Granata, Carlo Camilloni, Michele Vendruscolo, and Alessandro Laio; Pnas doi: 10.1073/pnas.1218350110
Credits immagine: Sissa
Se avete ricerche e studi da segnalare alla redazione per la rubrica “Ricerca d’Italia” scrivete a redazione@galileonet.it