All’inizio non si riconoscono le persone, non si riescono a evitare gli ostacoli, gli occhi seguono movimenti continui e involontari e, ancor più di notte, si ha una ridotta capacità visiva, che poco a poco viene persa del tutto. Si presenta così l’amaurosi congenita di Leber (LCA), una malattia genetica degenerativa della retina che si manifesta in età infantile con deficit visivi e che si trasforma in cecità tra i 30 e i 40 anni. Se prima non esisteva alcun trattamento per i pazienti affetti, recentemente la terapia genica si è rivelata una possibilità concreta di cura. Lo ha dimostrato un gruppo di ricercatori italo-americani con una sperimentazione clinica iniziata 4 anni fa su 12 pazienti di età compresa fra gli 8 e i 44 anni affetti da LCA di tipo 2, una delle forme più diffuse, caratterizzata dalla mutazione del gene RPE65, che codifica per una proteina coinvolta nel processo visivo.
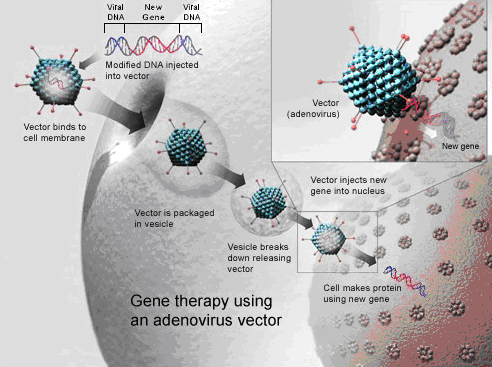
L’approccio clinico innovativo consiste nel correggere direttamente il difetto genetico alla base della malattia inserendo nell’occhio dei soggetti affetti e, più precisamente nello spazio subretinico, la copia normale del gene RPE65 veicolata da un “vettore”, cioè un virus adeno-associato (AAV), reso innocuo. In questo modo viene sintetizzata la proteina che innesca nuovamente il meccanismo della visione.
La sperimentazione ha previsto inizialmente l’iniezione del virus in un solo occhio e ha fornito risultati incoraggianti, in particolare nei soggetti più giovani, con un miglioramento della funzione visiva. Ma i risultati pubblicati lo scorso febbraio sulla rivista Science Translational Medicine da Jean Bennet del Children’s Hospital di Philadelphia rappresentano il vero traguardo clinico perché confermano l’efficacia e la sicurezza della terapia genica nel trattamento dell’LCA2.
Tre dei 12 pazienti trattati (i primi ad essere stati sottoposti al primo round di sperimentazione) hanno ricevuto un’iniezione del vettore nel secondo occhio che inizialmente non era stato trattato, con risultati incoraggianti già dopo 6 mesi. Si è osservata l’abilità a decifrare lettere, un miglioramento del riflesso delle pupille alla luce nonché la capacità del cervello di riconoscere i segnali inviati dalla retina con l’uso della risonanza magnetica funzionale. Anche gli altri 9 pazienti riceveranno la seconda iniezione. “È solo una questione di tempo – spiega Alberto Auricchio dell’Istituto Telethon di Napoli, che guida il team di ricercatori italiani insieme a Francesca Simonelli della Seconda Università di Napoli – quando il trial clinico è iniziato non esisteva una storia dell’iniezione di questo vettore negli occhi di un paziente umano. È stata eseguita, quindi, la prima su un limitato numero di pazienti con esiti positivi, e – dopo più di 4 anni – è stata fatta la seconda. Per come è disegnata la sperimentazione prima si inietta un paziente, si osserva che lo cose vadano bene e si passa al successivo, e così via. Così abbiamo proceduto per l’iniezione nel primo occhio, così si farà per il secondo. I dati osservati finora fanno ben sperare nell’uso della terapia genica anche per il trattamento di malattie più complesse e diffuse, come la maculopatia diabetica”.
Professor Auricchio, cos’è un virus adeno-associato e quali vantaggi presenta?
L’AAV è un virus modificato in modo da esprimere solo il gene terapeutico e nessuna proteina virale. È uno strumento sicuro perché non integra nel genoma della cellula ospite. In questo caso l’integrazione può essere evitata e non è richiesta perché le cellule della retina non proliferano. Inoltre, è un vettore che nella retina non suscita nessuna risposta immunitaria, che potrebbe limitare l’efficacia terapeutica del trattamento. Sebbene il guscio proteico del virus in cui è racchiuso il gene terapeutico stimoli la produzione di anticorpi, questi non rappresentano un pericolo per le cellule che hanno incorporato il vettore, che non vengono eliminate dal sistema immunitario. Possono essere, piuttosto, un limite per una seconda somministrazione perché è come se l’individuo fosse stato “vaccinato”. Tuttavia, è un problema che non esiste perché è ben dimostrato negli animali, e ora anche nell’uomo, che nello spazio subretinico, dove vengono inoculate le particelle virali, la somministrazione di un vettore AAV è possibile.
L’amaurosi di Leber è una malattia degenerativa: prima si interviene, meglio è. Da che età in poi è consigliabile trattare i soggetti affetti? E quali sono le percentuali di riuscita in pazienti di età avanzata?
Parlare di percentuali è avventato: si tratta di malattie rare, di 12 pazienti e di trial iniziali. Quello che si osserva, però, da questi piccoli numeri è che l’efficacia della terapia, ad esempio in termini di sensibilità alla luce, è sensibilmente più aumentata nei pazienti giovani, sebbene negli adulti si abbia un significativo miglioramento. Questo suggerisce che prima si interviene meglio è, fondamentalmente perché è una malattia degenerativa. “Prima” può essere anche in neonati: quando questa terapia giungerà (ci auguriamo) sul mercato e si diffonderà, speriamo di poter intervenire sui pazienti alla diagnosi, fatta generalmente a 6 mesi o un anno di vita.
Come sarà l’evoluzione dello stato patologico dei pazienti trattati: i risultati raggiunti finora persisteranno oppure ci sarà il rischio di una perdita dei vantaggi ottenuti, ovvero che il trattamento ceda a un “nuovo” processo degenerativo?
Quello che abbiamo visto finora è che a più di quattro anni dalla somministrazione nel primo paziente l’effetto sembra stabile da un punto di vista di efficacia, in termini di acuità visiva e di riflesso pupillare. Presumibilmente non c’è perdita di espressione di RPE65 nella zona trattata e non si va incontro ad una degenerazione. L’LCA2 è’ una malattia caratterizzata da visus basso già nei primi anni di vita: c’è prima un difetto funzionale che riguarda le cellule dell’epitelio pigmentato della retina (ed è lì che bisogna fare esprimere il gene) e poi una degenerazione, cioè la perdita delle cellule, che interessa i fotorecettori, ovvero le cellule che stanno al di sotto dell’epitelio. Per molti anni la retina è intatta, ma funziona come una macchina spenta in cui si dovrebbe girare la chiave per farla partire. Ad un certo punto i pezzi del motore si rompono e, quindi, anche se si gira la chiave non c’è nulla da fare. Si può immaginare di iniettare il virus tra due strati di una torta millefoglie: dove metti il vettore ci sono sia le cellule dell’epitelio pigmentato (sopra) sia le cellule che vanno incontro a degenerazione, i fotorecettori (sotto). L’importante è che il DNA entri nello strato superiore perché è lì che deve essere espresso il gene terapeutico. Se questo funziona bene anche i fotorecettori si salveranno. Quindi, ci auguriamo che almeno per l’area trattata l’effetto del transgene sia stabile o che non si perda con la degenerazione.