di Anna Lisa Bonfranceschi e Sandro Jannaccone
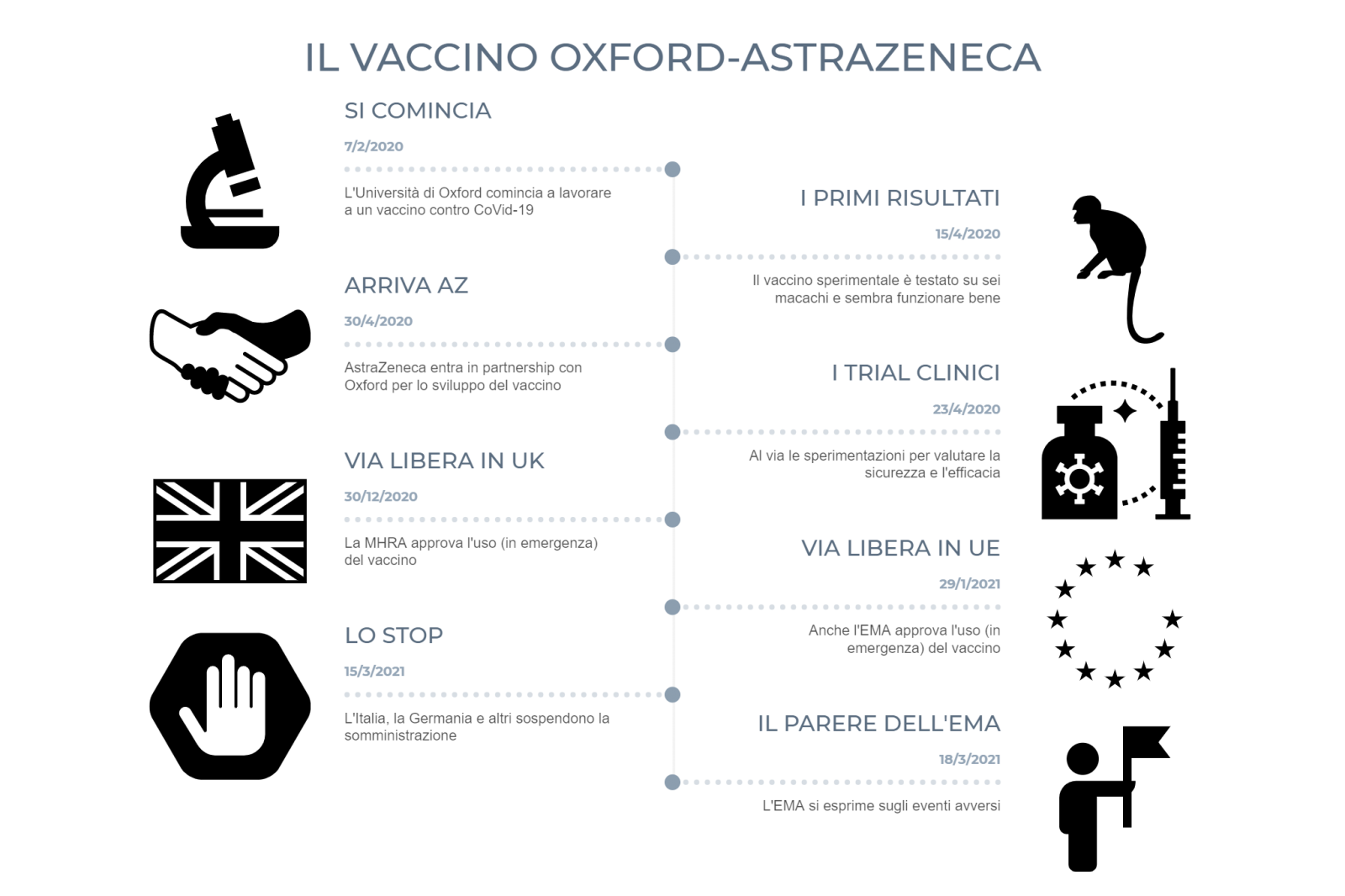
Sono giornate bollenti per AstraZeneca e il suo vaccino, sviluppato in collaborazione con l’università di Oxford e l’italiana Irbm. Ai problemi con la sperimentazione dell’anno scorso si sono aggiunti i timori di possibili gravi reazioni avverse che hanno indotto diversi paesi europei, tra cui l’Italia, a sospendere in via precauzionale la somministrazione. E alla fine è arrivato il giudizio dell’Agenzia europea dei medicinali (Ema), che conferma la sua sicurezza e sprona a riprendere la campagna vaccinale: al momento i dati raccolti sul campo ci dicono che il vaccino funziona e che i benefici superano gli eventuali rischi. Ecco un recap delle informazioni a nostra disposizione finora.
Approvato anche in Europa il vaccino di Johnson & Johnson
La sperimentazione
Come da prassi, le prime sperimentazioni del vaccino sono state concentrate sulla valutazione della sua sicurezza, ancor prima che della sua eventuale efficacia. I primi risultati sono stati pubblicati il 20 luglio scorso sul Lancet, in un report preliminare su un trial condotto su 1077 partecipanti sani e di età compresa tra i 18 e i 55 anni. Conclusione: “Non sono stati osservati eventi avversi gravi legati alla somministrazione del vaccino”. Gli autori hanno inoltre osservato un picco nella risposta anticorpale dopo 28 giorni: in virtù di questi risultati, hanno ritenuto “incoraggianti” i risultati del trial per “la valutazione del candidato vaccino su larga scala, in un programma di fase 3”.
All’inizio dell’autunno, un nuovo report, stavolta riferito (anche) a uno studio di fase 3 per un totale di 560 partecipanti di età maggiore a 18 anni, pubblicato sempre sul Lancet, ha ribadito la sicurezza del vaccino, “con un profilo di reattogenicità più basso negli anziani che nei giovani”. Gli autori del lavoro hanno osservato di aver notato (rari) casi di reazioni avverse gravi, considerate “non correlate alla somministrazione del vaccino” e “avvenute con la stessa frequenza con cui avvengono nella popolazione generale”.
Più tardi, a dicembre, questi dati sono stati esaminati più in dettaglio (e ripubblicati in due lettere su Nature Medicine, qui e qui): la nuova analisi si è in particolare concentrata sulle risposte immunitarie indotte dal vaccino negli adulti di età compresa tra 18 e 55 anni, e ha messo in luce l’importanza del richiamo che, somministrato a dose intera, migliora significativamente la risposta immunitaria indotta dalla singola dose.
Il trial clinico più esteso (o meglio, l’insieme di trial clinici, valutati poi in un unico studio) è stato condotto tra il 24 aprile e il 4 novembre su circa 24mila pazienti, di età superiore ai 18 anni e divisi tra Regno Unito, Brasile e Sudafrica e ha finalmente valutato l’efficacia del farmaco: l’analisi preliminare di questi dati, pubblicata anch’essa sul Lancet, ha dimostrato che il vaccino ha un’efficacia media (cosa significa? Ci torneremo tra un attimo) del 70% e che sembra anche ridurre la trasmissione del virus (è la questione dei cosiddetti vaccini sterilizzanti, su cui a tutt’oggi non è stata ancora messa la parola fine) dal momento che si sono registrate meno infezioni asintomatiche tra i volontari. In particolare, In particolare, i ricercatori hanno osservato 131 casi di Covid-19 sui 24mila partecipanti e confermato che il vaccino è sicuro, ossia non dà luogo a eventi avversi di grave entità, sottolineando però la necessità di continuare la sorveglianza per verificare la sicurezza e l’efficacia anche in altre popolazioni, tra cui quelle degli Stati Uniti, del Kenya, del Giappone e dell’India.
Tuttavia, la pubblicazione di questi risultati ha da subito fatto alzare più di un sopracciglio all’interno della comunità scientifica. La prima cosa che è saltata all’occhio degli esperti è che il comunicato di AstraZeneca (diffuso prima della pubblicazione dello studio, un’abitudine ormai purtroppo sempre più consolidata) parla di efficacia media, misurata prendendo in considerazione il totale dei volontari che hanno contratto la malattia coinvolti nelle varie sperimentazioni; il trial, però, non è omogeneo, nel senso che non tutti i volontari provengono dalla stessa sperimentazione e quindi non tutti sono trattati allo stesso modo: è un elemento che rende il risultato un po’ più traballante.
C’è dell’altro. Un ramo dello studio, invece di utilizzare una dose intera di vaccino alla prima somministrazione, ne ha data la metà ai suoi circa 3mila partecipanti. Senza nascondersi dietro un dito, Mene Pangalos, vicepresidente esecutivo della ricerca e sviluppo di biofarmaci di AstraZeneca, ha detto chiaramente che si è trattato di un errore, al cui riconoscimento, però, i ricercatori hanno deciso di non interrompere la sperimentazione, e di procedere comunque con il richiamo della dose intera quattro settimane dopo per constatare eventuali effetti nella differenza di dosaggio.
L’errore ha portato fortuna: somministrato in mezza dose più una intera, il vaccino ha raggiunto un’efficacia del 90%. Perché? Ancora oggi non ci sono spiegazioni definitive, ma solo ipotesi: potrebbe essere, per esempio, che una più bassa dose iniziale di vaccino sia più efficace nello stimolare un sottoinsieme di cellule immunitarie, le cosiddette cellule T, che supportano la produzione di anticorpi. Oppure potrebbe essere coinvolta la risposta immunitaria al vettore virale impiegato nel vaccino: alcune componenti dell’adenovirus degli scimpanzé modificato, utilizzato per indurre le cellule immunitarie ad armarsi contro la proteina spike del coronavirus, potrebbero a loro volta indurre una reazione immunitaria collaterale. E quindi una dose iniziale di vaccino più bassa potrebbe aver smorzato questo effetto, con il risultato di portare a una protezione migliore dal coronavirus a due settimane dal richiamo a dose intera. Questa ipotesi sembra tra l’altro essere supportata anche dai risultati di alcuni test sui topi, che indicano oltretutto una più rapida creazione di cellule immunitarie della memoria. Fatto sta che, nel complesso, il pasticcio con le dosi non ha certamente giovato all’immagine dell’azienda produttrice.
Dove e quante dosi sono state somministrate
L’efficacia del vaccino nel mondo reale
La storia del terzo vaccino approvato in Europa contro Covid-19 – movimentata, lo ricordiamo, già a livello delle sperimentazioni e poi con aggiustamenti sia negli schemi di somministrazione che nelle indicazioni per fasce d’età – ha avuto in parte il suo riscatto quando sono cominciati ad arrivare i dati di efficacia nel real world. Sono quelli provenienti dal Regno Unito, dalla Scozia in particolare, e non a caso, visto che è qui il vaccino è stato approvato e distribuito largamente ben prima che nel resto d’Europa. I dati provenienti dalla Scozia – in realtà riferiti alla distribuzione anche del prodotto di Pfizer-BioNTech – analizzavano gli effetti sulla riduzione delle ospedalizzazioni nella popolazione in relazione alla somministrazione del vaccino. Ed erano incoraggianti, come mostrato in un pre-print in materia: una singola dose del prodotto di AstraZeneca si associava alla riduzione del 94% delle ospedalizzazioni per Covid-19 considerando un intervallo di 28-34 giorni dopo la vaccinazione.
Pochi giorni dopo dal Public Health England (Phe) sarebbero arrivati nuovi dati sull’efficacia del vaccino (anche qui, dei vaccini, considerando anche Pfizer-BioNTech) negli over-70. Limitandoci all’analisi dei dati riferiti al prodotto di AstraZeneca, per una sola dose, si parla di una protezione da casi di Covid-19 sintomatici variabile dal 60 al 73%, e di stime di circa l’80% dal prevenire le ospedalizzazioni. Il punto di forza dello studio, sottolineavano gli autori, era non solo aver dimostrato l’efficacia di una singola dose (e quindi dar man forte alla strategia del Regno Unito che aveva puntato proprio in questa direzione), ma anche avere osservato livelli di protezione simili per i prodotti di AstraZeneca e Pfizer-BioNTech. E ancora: l’analisi ha fornito le prove che nella popolazione anziana il vaccino, spesso ritenuto un prodotto di serie B, è efficace.
Ripetendo una strategia già vista altrove – a Israele, paese leader nelle vaccinazioni – anche il Regno Unito (diversamente da Israele, grande utilizzatore del vaccino di AstraZeneca) si appresta a rimuovere gradualmente le restrizioni in vigore (che sembrano accompagnarsi a un miglioramento della situazione epidemiologica, contestualmente alla vaccinazione). Lo farà pero in maniera estremamente graduale, come scrive la Bbc, con un programma in cui muoversi verso le aperture a piccoli passi, trasformando il principio dello stay at home in quello di stay local.
Eventi avversi
La storia del vaccino di AstraZeneca, già di per sé complicata, subisce però un vero scossone solo negli ultimi tempi, con la sospensione di alcuni lotti del vaccino e quindi del prodotto stesso in diversi paesi europei dopo la segnalazione di alcuni possibili gravi eventi avversi gravi correlati al vaccino. Ma andiamo con ordine, cominciando dagli eventi avversi noti e dichiarati. Dolore, stanchezza, brividi, mal di testa, nausea, ma anche gonfiore nella zona di iniezione, diarrea, malessere e febbre sono indicati come effetti indesiderati comuni nel foglietto illustrativo del farmaco. Più rari, ma comunque possibili, sono situazioni quali sonnolenza, vertigini, diminuzione dell’appetito, ingrossamento dei linfonodi, sudorazione eccessiva, prurito o eruzione cutanea. La maggior parte degli effetti indesiderati lievi e moderati, come vi avevamo raccontato, è piuttosto comune.
L‘ultimo rapporto sulla sorveglianza dei vaccini dell’Aifa (aggiornato alla fine del mese di febbraio, e riguardante solo in piccola parte, circa il 3%, le segnalazioni relative ai vaccini AstraZeneca, arrivati da minor tempo) mostra che la stragrande maggioranza degli eventi avversi segnalati (circa il 90%) sono eventi non gravi, e afferenti a quelli noti, quali febbre, stanchezza, dolore al sito di iniezione, dolori muscolari, mal di testa, nausea e vomito. Febbre alta e sintomi sistemici sono invece indicati come la maggior parte dei sintomi gravi associati alla somministrazione del vaccino. Nel complesso, assicuravano da Aifa, venivano confermati i profili di sicurezza dei vaccini usati contro Covid-19, AstraZeneca compreso.
La sospensione e il sospetto per alcune trombosi
Nel giro di qualche ora però dalla diffusione del rapporto, tutto è cambiato: è arrivata la sospensione prima di un lotto del vaccino in Italia dopo la segnalazione di alcuni eventi avversi gravi (anche fatali) in persone che avevano ricevuto il vaccino AstraZeneca, che si è accompagnata alla sospensione di un altro lotto in altri paesi, parallelamente alla sospensione del vaccino in alcuni paesi. Decisione che ha poi riguardato anche l’Italia, come noto, in via precauzionale. Al centro dei timori in particolare la segnalazione di alcuni decessi e di eventi tromboembolici in collegamento temporale con la somministrazione del vaccino (ma il legame temporale tra due variabili da solo dice poco). Da subito l’Ema aveva specificato come il numero di eventi eventi tromboembolici nelle persone vaccinate – al dieci marzo si parlava di 30 casi su 5 milioni di di vaccinati – non fosse superiore a quello riscontrato nella popolazione generale, rassicurando sul fatto che i benefici del vaccino superassero i rischi collegati al suo utilizzo.
Sulla questione meramente numerico/statistica si era espressa anche l’Associazione italiana di epidemiologia, stimando l’incidenza di casi di ricoveri per trombosi venosa profonda attesi nella popolazione vaccinata in base all’incidenza della trombosi: circa 48-64 circa in un mese per gli 800mila vaccinati italiani. Numeri di per sé già ben maggiori degli eventi segnalati il 10 marzo da Ema. Su cui, come hanno ribadito però da subito le istituzioni vale la pena indagare, sia tramite indagini epidemiologiche che analisi a livello dei singoli casi. Soprattutto, e a maggior ragione, se invece in alcune circostanze, come apparso in Germania, si rivela un’incidenza di casi di condizioni rare maggiori alle attese: è il caso dell’aumento di una forma di trombosi venosa cerebrale (trombosi cerebrale del seno venoso), associata a trombocitopenia ed emorragia, rispetto a quanto atteso statisticamente.
In Germania, ha spiegato il Paul Ehrlich Institute (Pei) si sono infatti verificati 7 casi di questi rari eventi di trombosi (di cui 3 fatali) su 1,6 milioni di vaccinazioni, quando se ne sarebbe atteso solo uno. Un dato possibilmente correlato alla somministrazione della vaccinazione, scrivevano dal Pei, invitando a monitorare e rivolgersi al medico in caso di eventuali mal di testa persistenti fino a 14 giorni dopo la vaccinazione o la presenza di emorragia puntiforme della pelle. Al tempo stesso però dal Pei hanno ricordato la natura in ogni caso veramente rara dell’evento avverso, su cui come sappiamo è stata chiamata a esprimersi Ema.
L’esperienza britannica con il vaccino, il parere dell’Oms
Sul caso la stessa Ema ha spiegato di lavorare in collaborazione con l’agenzia britannica Medicines and Healthcare products Regulatory Agency (Mhra) per approfondire il caso. Nel Regno Unito infatti sono state somministrate 11 milioni di dosi del vaccino, e dall’Mhra l’invito allo scoppiare del caso nell’Unione europea, è stato quello a proseguire con le vaccinazioni, ribadendo che non ci fossero evidenze sul legame tra vaccino e coaguli sanguigni (che, considerati nel loro complesso, sono eventi abbastanza comuni ricordano) e che i profili di sicurezza dei vaccini riflettessero quanto visto nei trial clinici. Anche le reazioni di diversi esperti raccolte dal britannico Science Media Centre andavano nella stessa direzione, non riscontrando segnali particolari relativamente ai casi di trombosi associati alla campagna vaccinale e prevedendo al più, grazie al sistema di farmacovigilanza, l’identificazione di alcune rare categorie di pazienti per cui minimizzare il rischio associato alla vaccinazione.
A rispondere, prima dell’Ema, è stata l’Organizzazione mondiale della sanità, ribadendo che i benefici per il vaccino di AstraZeneca superano i rischi e che la vaccinazione anti-Covid-19 non avrebbe ridotto malattie e morti per altre cause, e in particolare che: “Gli eventi tromboembolici accadono con frequenza. Il tromboembolismo venoso è la terza causa più comune di malattie cardiovascolari al mondo”. E ancora: “Nelle estese campagne di vaccinazioni, è normale per i paesi segnalare potenziali eventi avversi che seguano la vaccinazione. Questo non significa necessariamente che sono collegati alla vaccinazione stessa, ma è buona pratica indagare. Mostra anche che il sistema di sorveglianza continua e che sono in atto controlli efficaci”.
E infine, di nuovo, il parere dell’Ema
Di tutto questo si parlava prima che ieri pomeriggio l’Agenzia europea dei medicinali rendesse noti i risultati delle indagini avviate proprio sulla base di questi timori da parte del suo Pharmacovigilance Risk Assessment Committee (Prac). E i risultati sono stati questi: i benefici del vaccino AstraZeneca contro Covid-19 continuano a essere confermati e sono maggiori dei rischi rappresentati da eventuali effetti collaterali e non ci sono prove di problemi a livello di produzione del vaccino. Ma, soprattutto, scrive Ema, il vaccino non è associato a un aumento del rischio complessivo di eventi tromboembolici (che anzi risultano anche minori nella popolazione vaccinata rispetto all’atteso nella popolazione generale) sebbene possano esserci rari casi di problemi di coagulazione associati a trombocitopenia, con o senza emorragie, inclusi rari casi di trombosi del seno venoso cerebrale. Casi molto rari – si parla in totale di 25 casi tra trombosi del seno venoso cerebrale e di coagulazione intravascolare disseminata su 20 milioni di vaccinati– per cui “un legame di tipo causale con il vaccino non è provato, ma è possibile e merita ulteriori analisi”.
Per questi ultimi casi stabilire la prevalenza nella popolazione normale non è semplice, proprio in virtù della loro rarità, va avanti Ema. Si tratta secondo le stime effettuate, di eventi avvenuti con maggior prevalenza nella popolazione vaccinata (5 casi in luogo di 1, e 12 in luogo di 1,35 rispettivamente per i problemi di coagulazione intravascolare disseminata e la trombosi del seno venoso), soprattutto giovane, sotto i 55 anni, e prevalentemente femminile. Ma sebbene si parli di un aumento, si tratta comunque di una “probabilità estremamente piccola”, scrivono ancora dall’agenzia, superata dall’efficacia del vaccino.
In ogni caso le note sui possibili rischi associati al vaccino AstraZeneca verranno incluse nelle informazioni del prodotto (nel foglietto illustrativo), le indagini e la sorveglianza rimarranno alte e si invita in particolare la popolazione (e personale sanitario) a prestare attenzione a sintomi di possibili problemi di coagulazione segnalandone ai medici. Sintomi quali: affanno, dolore al petto e allo stomaco, gonfiore o sensazione di freddo a un braccio o a una gamba, mal di testa grave e persistente, vista offuscata dopo la vaccinazione, sanguinamento persistente, piccoli lividi, macchie rosse o violacee e vesciche di sangue sotto la pelle.
Via: Wired.it
Credits immagine: Diana Polekhina on Unsplash